| 甲酸路易斯结构:绘图和详细说明 | 您所在的位置:网站首页 › 甲酸 结构式 › 甲酸路易斯结构:绘图和详细说明 |
甲酸路易斯结构:绘图和详细说明
|
在本文中,我们将讨论甲酸路易斯点结构。 最简单的羧酸是甲酸,通常称为甲酸。 它的化学式是H-COOH,其中R可以是H或烷基。 它是羧酸家族的第一个成员,也是自然界中发现的化学合成的重要阶段,尤其是在蚂蚁中。 甲酸路易斯结构式甲酸分子几何甲酸杂交甲酸的摩尔质量为 46.03 g/mol,沸点为 100.8 度,与水分子的沸点大致相同。 甲酸是一种白色液体,散发着强烈而弥漫的恶臭。 在水和极性溶剂中极易溶解。 在气相和碳氢化合物中,它以氢键二聚体的形式出现。 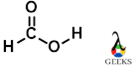 甲酸的简单结构 甲酸的简单结构甲酸中的化学键合 酸将在这里通过勾画其路易斯结构来讨论,了解其分子几何形状和杂交。 1. 甲酸路易斯结构:刘易斯结构,也称为电子点结构,是二维图,描述了分子中原子之间的键合电子对,以及原子上的孤电子对(如果存在)。 在原子的最外层发现的价电子负责键合和非键合。 除了氢和氦之外,一个原子更喜欢与其他原子形成键,其中每个原子的价壳包括八个电子。 素描的阶段 路易斯结构 如下面所述: 第 1 步:写下原子的电构型并计算分子中的价电子总数。 碳、氢和氧原子的电子构型为[He] 2s2 2p2,1年代1, 和 [他] 2s2 2p4, 分别。 因此,C、H 和 O 分别具有 4、1 和 6 个价电子。甲酸由两个氢原子和两个氧原子组成。 结果,甲酸的总价电子数为 4 + (1×2) + (6×2) =18 个电子。 步骤 2:作为中心原子,选择具有最多基团价的电负性最小的原子。 一个原子可以与其他原子建立的最大键数称为基团价。 C、H 和 O 的基团化合价分别为 4、1 和 2。 结果,碳原子将扮演中心原子的角色。 H、O 和 OH 基团将围绕甲酸骨架结构中的碳原子。 第 3 步:对齐分子骨架中的价电子。 刘易斯 甲酸的结构 有 18 个必须组织的价电子。首先,因为它是核心原子,所以从碳原子开始。 根据八位组规则,碳原子将被八个电子包围。 它将完成与碳原子直接相连的氢双峰。 碳原子和氧原子现在共享四个电子或两个电子键对。 它将有两个孤对电子来完成其八位字节(四个电子)。 以下 6 个电子将在 OH 基团中的碳原子之间共享。因此,甲酸很可能 路易斯结构 是: 单键将由两个键合电子形成,而双键将由四个键合电子形成。 结果, 路易斯结构 甲酸含量如下: 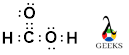 刘易斯点结构 甲酸 刘易斯点结构 甲酸分子的基本描述是 路易斯结构. 它没有提供有关分子形状或分子中原子杂交的信息。 为了实现这一点(VBT),需要价层电子对排斥(VSEPR)概念和价键理论。 2. 甲酸分子几何学:VSEPR 理论可以预测分子的几何形状或形式。 它处理键合和非键合(孤对)电子价壳电子排斥。 碳原子是原子的基本原子 路易斯结构 甲酸,具有三个键对,没有单电子对。当使用 VSEPR 理论预测分子的结构时,双键被视为一个键对。 因此,下表可以很容易地预测 甲酸的结构. 通式键对数分子形状/几何AX1线性推力器AX22线性推力器AX33三角平面AX44四面体AX55三角双锥AX66八面体甲酸在碳原子周围具有三角形平面结构,在氧原子周围具有四面体几何结构,主要是由于它包含两个孤对和两个键对。 3. 甲酸杂交:杂化是结合原子轨道以产生等效能量杂化轨道的过程。 杂化轨道在数量上与原子轨道相同。为了建立共价键,产生的杂化轨道与其他原子的杂化轨道或与原子轨道重叠。 在甲酸中,碳原子的杂化可以通过以下方式计算: 基态碳原子的电构型为[He] 2s22p2. [He] 2s12p3 激发态构型是来自 2s 轨道的电子之一激发碳原子的 2p 轨道。 由于碳原子与其他原子形成三个 sigma 键,因此其中一个碳原子上的两个 2s 和两个 2p 轨道之一将混合产生三个 sp2 杂化轨道,而其中一个 p 轨道将保持未杂化,从而产生 pi与氧原子连接。 碳原子是 sp2 杂化并且氧原子之一同样是 sp2 杂化,而另一个与氢和碳原子偶联的氧原子是 sp3 杂交。 |
【本文地址】